IVD原料处于整个产业链上游,其品质的优劣决定了体外诊断试剂质量和最终诊断结果的准确性,是产业链的核心环节之一。
一、IVD原料概述
广义IVD原料上包括用于制备体外诊断试剂的生物活性/非生物活性材料,和研制体外诊断设备所需的零部件,狭义上的IVD原料指用于生化、免疫或分子诊断等试剂的反应体系原料,包括核心反应体系、信号体系、反应体系载体、反应环境四部分,其中核心反应体系原材料如抗原、抗体、诊断酶对体外诊断试剂质量起着重要作用,是体外诊断试剂的关键。
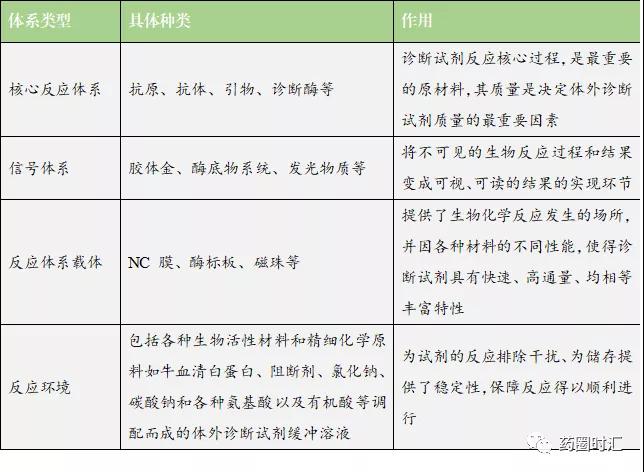
1. 抗原抗体
抗原和抗体是制备免疫诊断类试剂的重要原料,抗原包括重组抗原、天然抗原等,通过基因工程重组技术、蛋白纯化技术、细胞生物学技术及化学合成技术等方法制备;抗体包括单克隆抗体及多克隆抗体等,通过免疫技术、杂交瘤细胞技术、细胞发酵技术等方法制备。
抗原抗体反应由于具备特异性、可逆性、最适比例和敏感性等特点被广泛用于以免疫反应为基本原理的诊断试剂中,同样这些性能也是试剂生产商对原材料性能考量的重要指标。
2. 酶原料
酶是生化诊断和分子诊断的核心原料,也是免疫诊断中酶-底物信号体系中不可或缺的成分。生化酶在临床中广泛的应用于以下两个方面:①根据体内与疾病有关的酶活性变化来诊断某些疾病,例如测定转氨酶活性变化来诊断肝病;②利用酶来测定体内与疾病有关的物质的量来对疾病进行诊断,例如利用葡萄糖氧化酶测定血糖含量来诊断糖尿病。
分子诊断酶是聚合酶链式反应(PCR)、核酸分子杂交技术和生物芯片技术等分子诊断技术不可或缺的原材料,包括产品种类可包括各种热启动聚合酶、常规聚合酶、逆转录酶、一步法试剂以及测序用的整套酶等。
3. 其他常见诊断试剂原料
其他原料是除上述发生核心反应的活性物质外的原料,其他常见试剂的原材料主要有底物、标准品等。底物为各类生物化学反应提供了稳定且必要的反应环境,是各类体外诊断不可或缺的基础原料。标准品是指用于鉴别、检查、含量测定的标准物质。
2、市场空间、
受惠于诊断检测量的增加以及新标志物的发现,全球体外诊断试剂原料市场近年来保持稳定增长。2019 年全球体外诊断试剂原料市场规模预计约为人民币303.3 亿元,预计至2030 年,全球体外诊断试剂原料市场规模可达人民币约565.3 亿元。全球体外诊断试剂原料市场突出地体现为参与者众多、个体规模较小、行业高度分散的特点,即使像Hytest、BBI Solution、Meridian、菲鹏生物等头部企业的全球市场份额也不足5%,而大量中小实验室以供应数款特色项目在行业内占据一席之地。
随着我国体外诊断行业的快速发展,带动上游原料的市场快速扩大,根据弗若斯特沙利文报告,国内IVD原料市场规模从2015年的33亿增长至2019年的82亿元,年复合增长率为25.8%;预计 2024 年的市场规模将达到 200 亿元,2019 -2024年均复合增长率将达到 19.4% 。
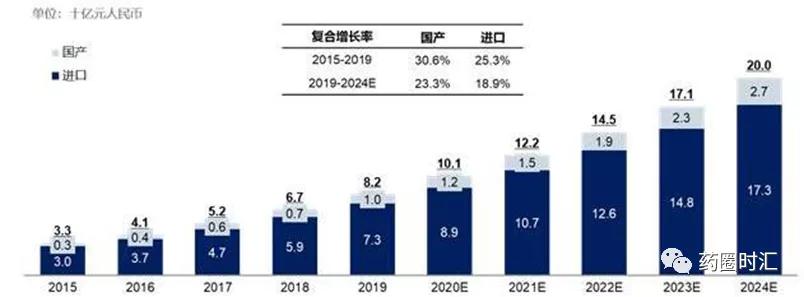
从市场竞争格局来看,进口产品依然占据IVD原料市场主导地位。2019年,进口产品市场规模为73亿元,占IVD原料市场的88%,国产产品市场规模为10亿元,占比较小,但是发展速度较快,2015-2019年复合增长率达30.6%,高于进口产品增速。
随着国内企业技术水平不断提升以及对生物科技产业供应链本土化重视程度不断加强,预计国产体外诊断试剂原料市场规模将以23.3%的年复合增长率增长,到2024年达到27亿元,逐步实现进口替代。
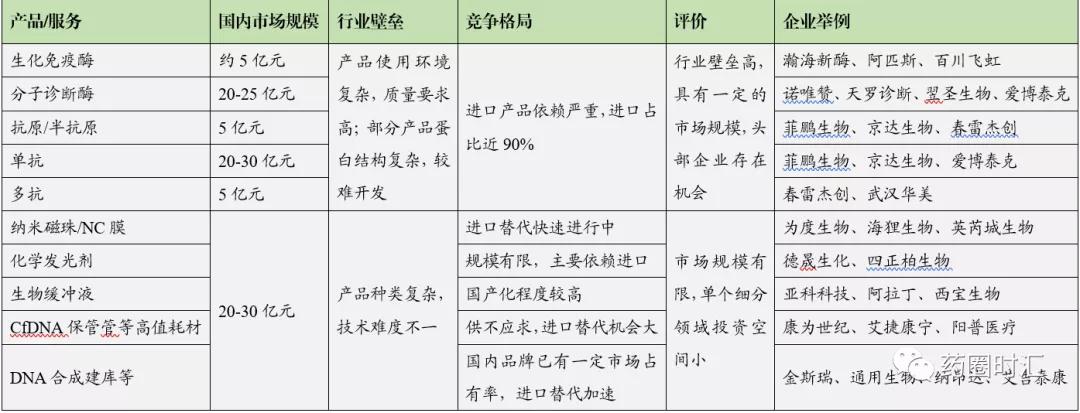
根据兴业证券研究所,预测了IVD原料市场各细分领域的市场空间如下表:
3、行业特点
1.IVD原料供应商往往“小而美”,聚焦于其所专长领域,与科研试剂市场的“大而全”形成明显的对照。目前被批准使用于临床检验的项目不过千余种,按照方法学都可以归为生化反应、酶底物反应、抗原抗体反应、PCR反应这几类,因此所需原料产品数种类不会很多,而且体外诊断涉及的疾病范围广泛,传染病、肿瘤、心血管、代谢等每一类疾病都代表独立的学科。
作为抗原抗体原料供应商,只有对该疾病和疾病标志物进行长期、专注的研究,才能研发优质的原料应用于疾病诊断,这进一步使得免疫原料的源头供应商通常专注于少数几个疾病领域,如HyTest拥有毋庸置疑的心血管原料第一品牌定位,Microbix则凭ToRCH抗原独树一帜。
2.下游IVD试剂技术更新和市场增长,带动上游IVD原料同步更新与增长。中国体外诊断市场在过去五年保持两位数以上增速,2015 至2019期间年化复合增速达到17.2%。未来,受行业长期稳定增长、分级诊疗加快推进以及个性化医疗与精细化管理的实施等利好因素驱动下,中国体外诊断市场有望保持快速增长,并推动上游体外诊断试剂原料产业同步增长。
3.高资金和强监管壁垒使得行业的准入难度加大。IVD原料研发环节需投入适配技术平台以保证原料质量要求(如稳定性、灵敏度、特异性与线性检测范围等),在生产环节需搭建生产管线与设施以满足原料质量管理规范要求,在存储与运输环节要求苛刻的环境条件确保原料维持生物活性,在营销环节需投入费用开拓及占领市场渠道并铺张广泛营销网络以持续建设品牌,所需资金量大,同时体外诊断试剂受政府严格监管,体外诊断试剂注册(备案)制度倒逼上游原料质量要求抬升、准入壁垒加高。
4.国产IVD原料企业技术工艺不足,市场被跨国企业垄断。国产IVD原料在品控、生产工艺及纯度质量上与进口存有差距,导致下游体外诊断试剂生产企业所需关键性原料仍依赖进口。而且替换IVD原料可能导致产品质量不稳定,并需要重新进行注册申报,因此下游IVD客户粘性较大,国内企业短期内较难实行进口替代。目前国内仅有少数企业能实现部分原材料自给,但一些关键性的原料仍依赖进口。
迈瑞医疗2021年 5 月16 日公告,以总价约5.45 亿欧元收购Hytest Invest Oy 及其下属子公司100%的股权。HyTest 成立于1994 年,总部位于芬兰,主营业务为体外诊断用抗原抗体等试剂原材料的研发、生产及销售,是全球领先的免疫诊断原料供应商。迈瑞医疗此举动作也是为了实现IVD原料的可控供应,避免被“卡脖子”。
4、痛点在哪里?
IVD原料处于整个产业链上游,其品质的优劣决定了体外诊断试剂质量和最终诊断结果的准确性,是产业链的核心环节之一。
IVD核心原料涉及抗原/抗体、诊断酶等其他核心原料的其研发难度大,生产工艺流程复杂,需要长期的研发积累,保证其产品质量。近十年国内IVD原料随着国内体外诊断产业发展有一定的滞后性,作为诊断试剂的上游,IVD原料市场空间小,国内公司规模普遍不大,研发能力欠强,工艺稳定性不佳,产品质量不高。
1. 抗体
现阶段,国内大多数免疫诊断试剂依然以使用进口原料为主,主要的抗原抗体进口厂商有HyTest、Medix、Meridian和Biospacific等,这些公司均有着数十年的发展历史,对于抗体的研发生产和质量管理均有着系统化的控制。抗体的质量控制是保证体外诊断试剂质量的重要环节,包括原料质量控制、细胞库质量控制和生产纯化质量控制三个环节。
高质量的原料是获得高质量IVD原料产品的保障,其中包括对于动物源品质的控制、培养基质量的控制、生物安全性检测等。由于行业竞争激烈,目前部分生产厂商为了压缩生产成本从而降低了原料的质量控制,这也是我国目前抗体生产行业质量参差不齐的重要因素。
细胞库的系统化管理、合理的细胞储存、传代、培养是保证高质量抗体的前提。杂交瘤细胞在数次传代后会出现活力逐步下降现象,当细胞活力不足时会导致所生产的抗体活性大打折扣。另外,若细胞株保存不善受到污染,将会造成不可设想的严重后果。因此细胞株科学的保存、复苏及传代是非常必要的。
目前单克隆抗体的生产方式主要分为体内培养和体外培养两种,在获得培养产物后(体内培养为小鼠腹水、体外培养为悬浮培养液),通过一定的纯化步骤便可获得最终的抗体。在纯化过程中,保证各项参数和原料的稳定是降低纯化后抗体的批间差的重要因素。此外,不同抗体在使用同样纯化工艺纯化时,所得的产物可能会出质量差异。因此,对于不同的抗体选择针对性的纯化方式是非常重要且必须的。
开发高品质抗体检测原料需要对抗体特性进行优化评估,国内厂商积淀缺乏。
检测靶标又叫做生物标志物(biomarker),大多数情况下在病理状况下和正常生理条件下是不一样的,甚至同一标志物在不同疾病中也会有所不同,用于免疫检测的抗体或抗原必须具有针对性才能有效评估相关疾病。
目前生产单抗的技术已经成熟,生产相对容易,难点在于诊断试剂抗体原料产品的研发,研发重点是对这些抗体产品筛选和评估,找到一个可以评估特定原料在其特定疾病中的应用的方法,得到针对性的检测指标,才进入了实质意义的开发。相应抗体筛选过程非常复杂,没有统一的模式和方法,需要对疾病的生理和病理过程很深的认识,而且需要不断的积累。
国内很多原料供应商会避开原料研发这个步骤,除了缺乏相应的疾病相关的生物学理论知识,认知上把对原料的评估步骤归划到客户手中,认为这应该是试剂开发商的事,自己的任务只是为客户提供抗体选择,如何选择完全由客户负责。这其实是国内原料生产商和国外的最大差别;国际知名的抗体公司投入抗体评估的费用占总开发费用的50%以上,大量的人力物力都是在手中的抗体进行定性,其销售的抗体通常提供大量的临床数据。给到IVD公司手中的原料几乎都是可以高效识别相应疾病标志物的产品,客户只需要集中精力来调试其针对自身平台的应用条件。因此,国产IVD供应商不管是在技术基础和供应链方面均存在较大不足,要替代进口原料可能还需要走很长的路。
2. 抗原
抗原作为主要的核心原材料,对于整个免疫检测分析系统有着至关重要的影响。除去试剂制备工艺外,抗原自身的性能可在很大程度上决定着检测试剂的质量。
影响抗原活性的因素有:抗原的生产路径——进行天然提取或重组、合成;采用原核细胞或真核细胞表达;以游离形式或多聚体形式甚或带有载体;甚至产品以冻干粉、冻液或液体形式交付,都可能影响抗原的生物活性,需经过原料厂商严谨细致的反复验证。
3. 诊断酶
诊断酶作为体外诊断生产商的核心原料,对于生产成本,产品质量和稳定性有着决定性的影响。由于诊断酶技术门槛高,自主研发难度大,目前体外诊断生产企业主要进口诊断酶,国际上主要的诊断酶生产厂家都有几十年的历史,酶产品质量稳定,批间差小,但是存在价格高,货期长等弊端。
诊断酶的主要供应商为Roche,TOYOBO,Sekisui Diagnostic(原Genzyme Diagnostic),AsahiKASEI,BBI Solutions等。近几年,因为生化诊断市场竞争趋于红海,为了控制上游成本,有些诊断企业开设原料研发部门,生产出的原料酶应用于内部生产,从而控制成本,控制原料质量,控制上游原料供应风险。
一般体外诊断生产商需要采购大量的诊断酶作为原料,由于生物体内酶的含量低,不能适应工业化生产的需要,酶的生产厂家很多采用微生物的发酵来制取,在适宜的条件下,选育出所需要的菌种,让其进行繁殖,通过发酵工艺获得大量的酶。
4. 国产IVD原料供应商困境
体外诊断下游厂家在研发阶段,为保证产品质量,需要花费大量时间和成本来验证原材料的可靠性,一旦选定品质优良的原料供应商,会产生很高的客户粘性,一般试剂厂商都习惯性选用进口的关键原料和关键部件。
另外,体外诊断试剂的毛利率比较高,下游生产企业选用国产原料和动力不高,而对于已经研发完成的产品,如果要变更关键原料和关键部件,按照现在的医疗器械的管理条例,需要重新注册或者注册检验,因此只有在有很大的成本压力的情况下,下游厂家才有意愿去选用国产关键原料和关键部件,进一步造成国产化替代的成本较高。
此外,国内大部分体外诊断试剂或仪器厂家对于国产原料存在歧视性对待,导致原料厂商处于弱势地位即使在产品质量过关的情况下,也常常会面对客户过分的价格要求导致难以获得合理的利润进一步发展壮大。
5、如何破局?
1. 提升自身的创新能力与产品质量是发展的核心动力。IVD核心原料产业是牵一发而动全身的战略领域,该领域的发展和进步,既保障了体外诊断产品生产研发的战略安全,也很好的解决了受制于人和确保产品安全生产的备胎问题。
对于我国本土化的上游原材料生产企业而言,需要更加系统,严谨的进行有效的质量控制,从原材料、研发、生产工艺、质量控制等全过程必须严格把关,保证核心原料的质量。
2. 充分利用本土化优势为IVD原料国产替代进行赋能。跨国企业掌握核心原料工艺技术,进口产品质量较国产产品优势明显,但跨国企业在市场渠道上并无明显优势,冗杂的经销代理模式抬高进口原料产品价格,不利于跨国企业在中国市场渗透产品。
本土企业在产品线布局、供货周期及沟通营销渠道上相比于跨国企业优势突出,本土企业可针对中国特殊诊疗需求战略性开发适配原料,以贴合市场需求,而且国产化原料生产周期及运输程序更为可控,供货周期更短,本土企业较跨国企业与需求方沟通渠道及沟通成本更低廉。
因此,国产IVD原料厂商可以充分利用本土化的优势助力企业发展,在技术革新基础上,国产原料独特优势将得以进一步发挥以共同助力国产体外诊断原料发展。
6、未来趋势
2020年,国内共有7家上游原材料企业完成融资,2家企业申报IPO。国内具有成熟工艺及规模生产能力的原料厂家如菲鹏生物、诺唯赞、爱博泰克等相继在一级市场获得巨额融资。在注册制的利好下,菲鹏生物和诺唯赞也争先叩响二级市场大门。2021年,纳微科技、百普赛斯率先敲钟上市。
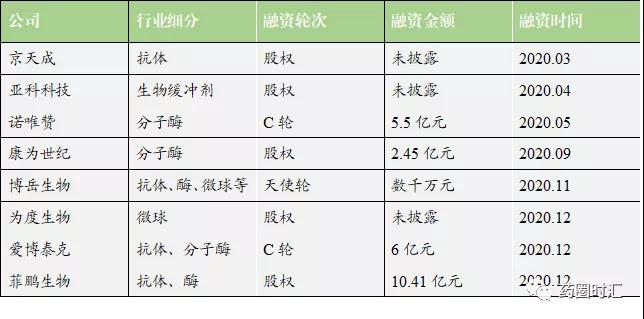
根据菲鹏生物招股书显示,传统原料业务2017~2019年复合增长15%,从2.2亿攀升至2.9亿,2020年上半年业绩接近5亿,主要依赖疫情带来的抗体和诊断酶业务暴增,设备试剂整体方案业务(提供OEM服务)当中试剂部分在2020年也达到1亿规模。
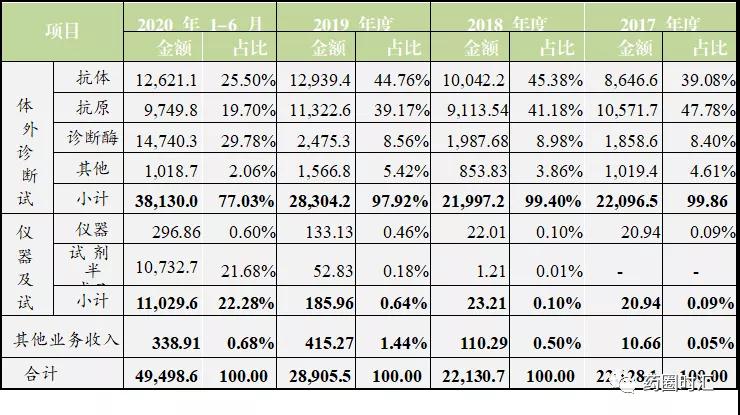
诺唯赞招股书显示,诺唯赞业绩2017~2019年从1.1亿至2.6亿实现了快速攀升,并在2020年上半年达到了7.9亿,其中POCT诊断试剂收入达到3.5亿,占比接近45%。诺唯赞作为上游原料厂家不甘于原料市场,自己搭建POCT平台向下游进军,与原料客户一起切分IVD下游诊断试剂市场。
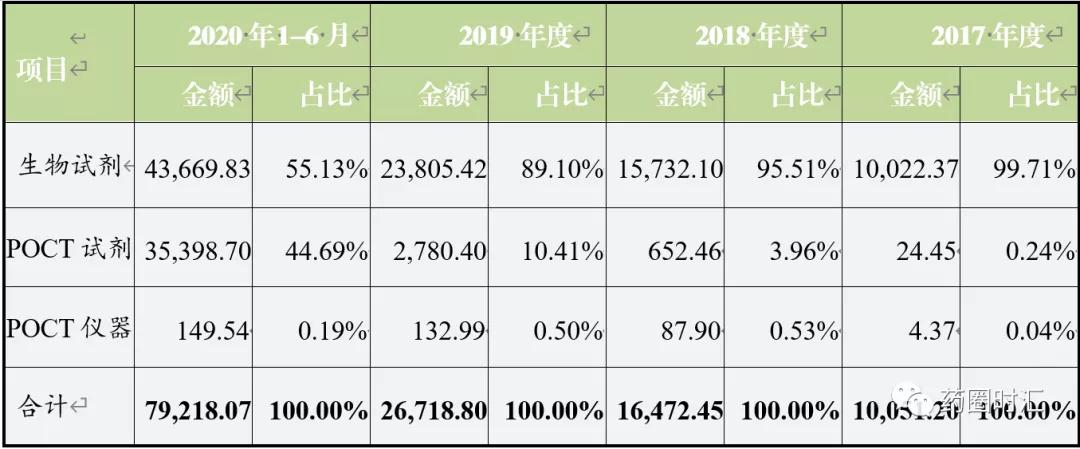
2020年新冠疫情导致的IVD原料冲击,以及一二级市场对IVD原料厂家的追捧,未来像爱博泰克这类具有媲美甚至超越国际品质的原料企业,也将迎来广阔的发展空间。
根据浩悦资本分析,中国IVD原料市场高度分散,单一企业很容易触及天花板,因格局稳定导致试剂原料供应可替代性低。未来的行业发展可能会有如下几个方向:
1. 提供从原料、半成品试剂到配套设备的整体解决方案。国内领先原料公司菲鹏生物为代表,不满足于仅提供关键原料,而且合作第三方搭建检测体系,并基于原料优势开发半成品试剂,以便快速赋能下游诊断公司客户,为客户提供各种形式的服务方案。菲鹏生物25亿巨额募资款当中,占比最大约8.8亿将投入于设备试剂整体方案,为下游客户提供原料、半成品试剂、配套仪器平台全系列的上游产品。
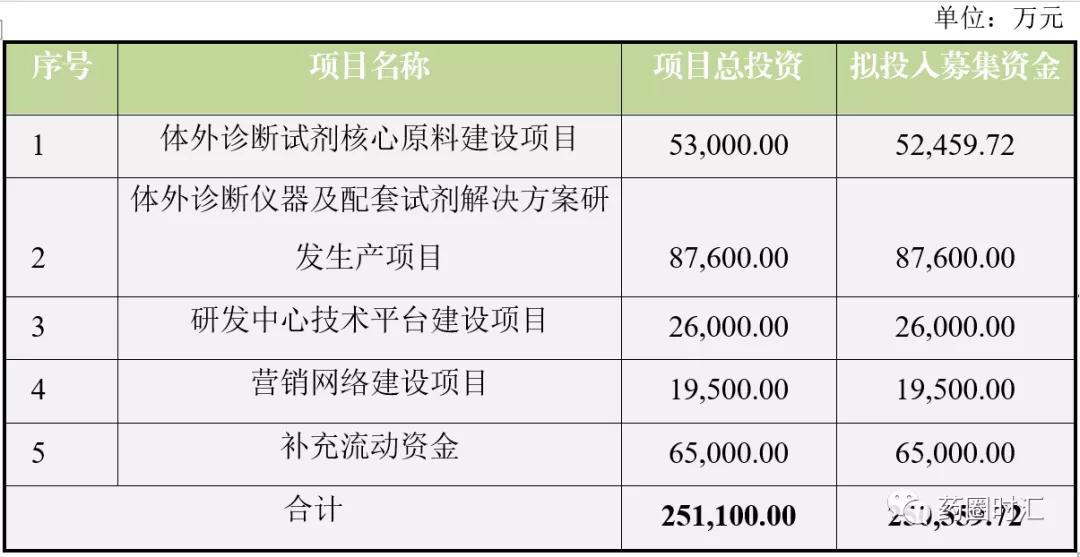
2. 以原料为优势,自主报证搭建平台向下游拓展。诺唯赞为该模式的代表企业,这类公司基于在体外诊断产品关键原料领域的研发与生产能力,可提供新技术或稀缺指标关键原料。为了充分发挥其关键原料攻克价值,这类公司将不满足仅提供原料,通过配套设备及试剂盒,自主报证进入下游市场。优势在于其业务模式的拓展,市场空间得到提升,当临床认可新技术或稀缺标志物后,可进一步带动其原料业务;劣势在于原有客户会因存在竞争而选择其他原料商合作,或下游开拓存在风险。
3. 聚焦原料产业核心技术,扩大品牌影响力。除了围绕上下游产业链延伸,聚焦原料平台进行横向拓展成为全球性原料平台也是不错的选择。原料行业的技术、工艺、生产、销售、品牌多维度壁垒较高,并且顶尖的原料商一定不是跟随技术潮流,而是深耕研发立志于引流潮流。这类企业可以从科研到IVD原料全覆盖,聚焦原料研发技术及工艺打磨,建立自身优质原料提供商的品牌。
4. 横向并购扩大企业产品线,打造全球原料平台。国内IVD原料企业大部分业务方向较为单一,容易触及天花板,通过并购,尤其是海外并购来扩大经营规模将呈现诸多优势:扩充产品线,推动产品升级;获取优质客户,进行客户升级;增厚营收和利润;4. 建立品牌、掌握行业话语权,为整体解决方案奠定基础(如Hytest、TOYOBO、Rockland等)目前国内IVD企业已经开始在国际舞台展露头角,未来IVD原料企业也完全有机会争霸全球。
7、相关企业
1. 罗氏诊断

罗氏创立于1897 年,主营业务分别为药品销售和体外诊断业务。罗氏是全球领先的生物科技公司,每年研发投入约90亿瑞士法郎。作为世界上最大的生物技术公司之一,罗氏是体外诊断领域的全球领导者,已形成覆盖体外诊断全产业链的原料、试剂和仪器平台研发和生产能力,其原料生产主要供内部试剂生产使用,外部销售占比较低。
罗氏诊断在2019 年全球总收入达到了129.5 亿瑞士法郎,其中在包括中国在内的E7 国家(含巴西、中国、印度、墨西哥、韩国和土耳其)的市场收入增速达到7%。
2. HyTest

HyTest 成立于1994 年,是一家总部设在芬兰的国际性公司,主营业务为体外检测产品的开发和抗原抗体的生产,在心肌标志物等部分项目原料供应市场处于领导者地位。HyTest 产品主要销往中国、欧洲和美国。得益于中国市场的良好表现,HyTest 2019 年的总营收增长达到10%,总收入约为2.99 亿瑞典克朗。
3. Meridian

Meridian成立于1976 年,主要业务分为诊断和生命科学。诊断板块的细分业务包括开发、制造、销售和分销诊断试剂盒,产品用于部分胃肠道和呼吸道传染病检测,以及血铅水平检测。体外诊断原料相关的生命科学板块主要涉及制造和销售抗原、抗体、PCR 酶和核苷酸等产品。Meridian 生命科学板块业务多为收购整合形成,该板块2017 年-2019 年的收入分别为5,725.0 万美元、6,311.7 万美元和6,433.2 万美元。
4.菲鹏生物

菲鹏生物是行业领先的体外诊断原料供应商,公司以诊断试剂原料业务为基石,经过近二十年的发展,构建了完善的生物活性原料核心技术平台,全面覆盖免疫、分子、生化等主流原料筛选和检测,已成为行业领先的诊断试剂原料供应商。目前,公司在重大传染病、呼吸道传染病、热带病、心肌、肿瘤、炎症等临床应用领域具有较大影响力。公司于2007 年正式进军国际市场,已发展成为新兴市场区域的主流原料供应商,也进入了欧美等发达国家市场,体外诊断试剂原料出口的代表品牌。(公司已申报创业板上市)
公司也重点布局了化学发光、基因测序仪和POCT 荧光免疫等仪器平台,以及化学发光、分子诊断与生化诊断试剂解决方案,在行业内引领性地形成了“核心生物活性原料+试剂整体开发方案+创新仪器平台”整体解决方案服务能力。
5. 诺唯赞生物

诺唯赞生物是一家围绕酶、抗原、抗体等功能性蛋白及高分子有机材料进行技术研发和产品开发的生物科技企业,依托于自主建立的关键共性技术平台,先后进入了生物试剂、体外诊断业务领域,并正在进行抗体药物的研发,是国内少数同时具有自主可控上游技术开发能力和终端产品生产能力的研发创新型企业。(已申报科创板上市)
公司选择不同的基因工程突变体作为原料开发生物试剂,现已开发超过500种生物试剂,形成了PCR系列、qPCR系列、分子克隆系列、逆转录系列、基因测序系列、Bio-assay系列、提取纯化系列、基因编辑系列和细胞/蛋白系列等多个产品系列。
在体外诊断领域,公司自主研发、生产POCT诊断试剂,包括量子点免疫荧光试剂、乳胶增强免疫比浊试剂和胶体金免疫层析试剂等,共有心脑血管、严重感染、优生优育、胃功能、自体免疫、肾功能、慢病管理和呼吸道8个系列产品及配套质控品。
6.瀚海新酶

瀚海新酶”成立于 2015 年,是一家专业从事特种酶的研发、生产、应用和技术服务的高术类企业,产品涵盖体外诊断原料、绿色生物催化用酶、分子生物学用酶及相关的技术服务并为生物产业提供高品质的研发、生产物料及适配的解决方案。
瀚海新酶的酶工程技术平台实现关键性技术突破,30多种特种酶活性、稳定性、底物特异性质量提升并达到国际水平,其系列产品在IVD制造商、高校科研院所及医院的实验室、生物制药企业等领域确立品牌特色和产品优势,并获得知名试剂厂家、科研院所认可。
公司产品包括体外诊断原料产品及试剂定制产品两类,适用于肾、肝、血脂、血糖功能诊断及科学研究等途径。体外诊断原料产品包括生化诊断、化学发光、分子诊断等细分体外诊断试剂原料,试剂定制产品包括酶法试剂与免疫比浊两类定制产品。
7.阿匹斯生物

阿匹斯生物成立于2009年,是一家专业从事生物化学制品的研发、生产和经营的高新技术企业,也是北京利德曼生化股份有限公司(股票代码:300289)的全资子公司。
阿匹斯通过自主研发和国际合作,持续创建中国优质生物化学领域品牌。经过几年探索及钻研,在IVD制造商、高校科研院所、医院实验室及生物制药企业等产业链环节中确立自身品牌特色和优势,并获知名试剂厂家、科研院所的信赖,拥有稳定客户群体。
阿匹斯产品线包括IVD原料、生物制药原辅料、精细化学品、食品安全及动物疫病检测产品。同时企业也为生物技术公司、生物制药、食品企业及高新材料行业提供高品质的研发、生产物料。在IVD原料领域,阿匹斯产品包括酶及辅酶、蛋白抗原、单抗系列、多抗系列及化学产品等,产品规格可定制。
8、翌圣生物

翌圣生物科技(上海)股份有限公司成立于2014年,是一家专注于工具酶原料及抗原抗体研发与生产的高新技术型企业,致力于为生命科学领域内的客户提供高质量的产品和优质的服务。产品涵盖科学研究相关PCR、qPCR、RT-PCR、克隆、细胞培养与检测、支原体预防与检测、抗原抗体等基础生物学试剂,以及精准医疗领域相关核心酶类制剂产品、高通量测序类试剂盒、分子诊断检测类试剂盒、药物生产原料与检测等多种试剂和试剂盒,相关分子诊断酶原料及制药酶相关原料酶30Kg/年,具备国际一流品质。
声明:转载此文是出于传递更多信息之目的。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 邮箱地址:zhanya2011@126.com