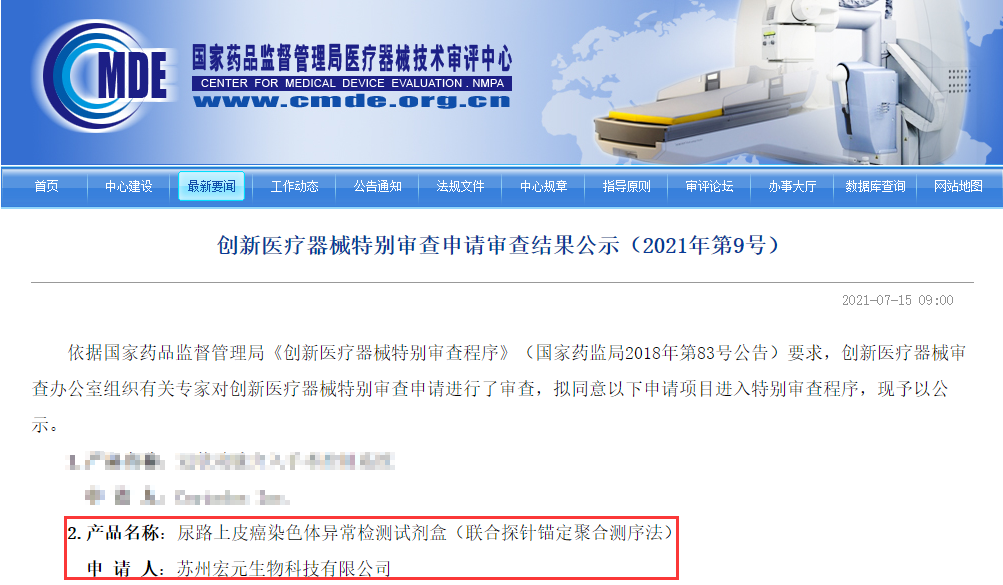
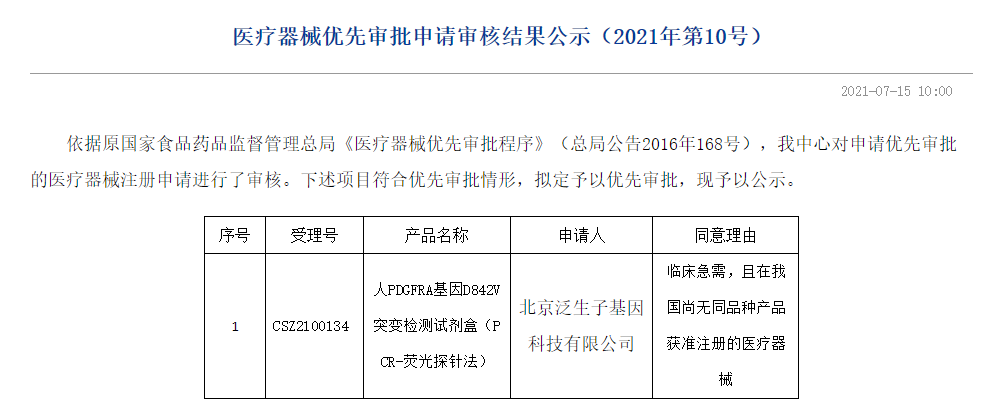
7月15日,器审中心发布两则公告,同意苏州宏元生物科技有限公司的尿路上皮癌染色体异常检测试剂盒(联合探针锚定聚合测序法)项目进入特别审查程序,对北京泛生子基因科技有限公司的人PDGFRA基因D842V突变检测试剂盒(PCR-荧光探针法)项目拟定予以优先审批,该款产品属临床急需,且在我国尚无同品种产品获准注册的医疗器械。
2018年发布新修订的《创新医疗器械特别审查程序》指出针对具有我国发明专利、技术上具有国内首创、国际领先水平,并且具有显著临床应用价值的医疗器械设置特别审批通道。
《医疗器械优先审批程序》规定,对符合下列条件之一的境内第三类和进口第二类、第三类医疗器械注册申请实施优先审批:
(一)符合下列情形之一的医疗器械:
1.诊断或者治疗罕见病,且具有明显临床优势;
2.诊断或者治疗恶性肿瘤,且具有明显临床优势;
3.诊断或者治疗老年人特有和多发疾病,且目前尚无有效诊断或者治疗手段;
4.专用于儿童,且具有明显临床优势;
5.临床急需,且在我国尚无同品种产品获准注册的医疗器械。
(二)列入国家科技重大专项或者国家重点研发计划的医疗器械。
(三)其他应当优先审批的医疗器械。
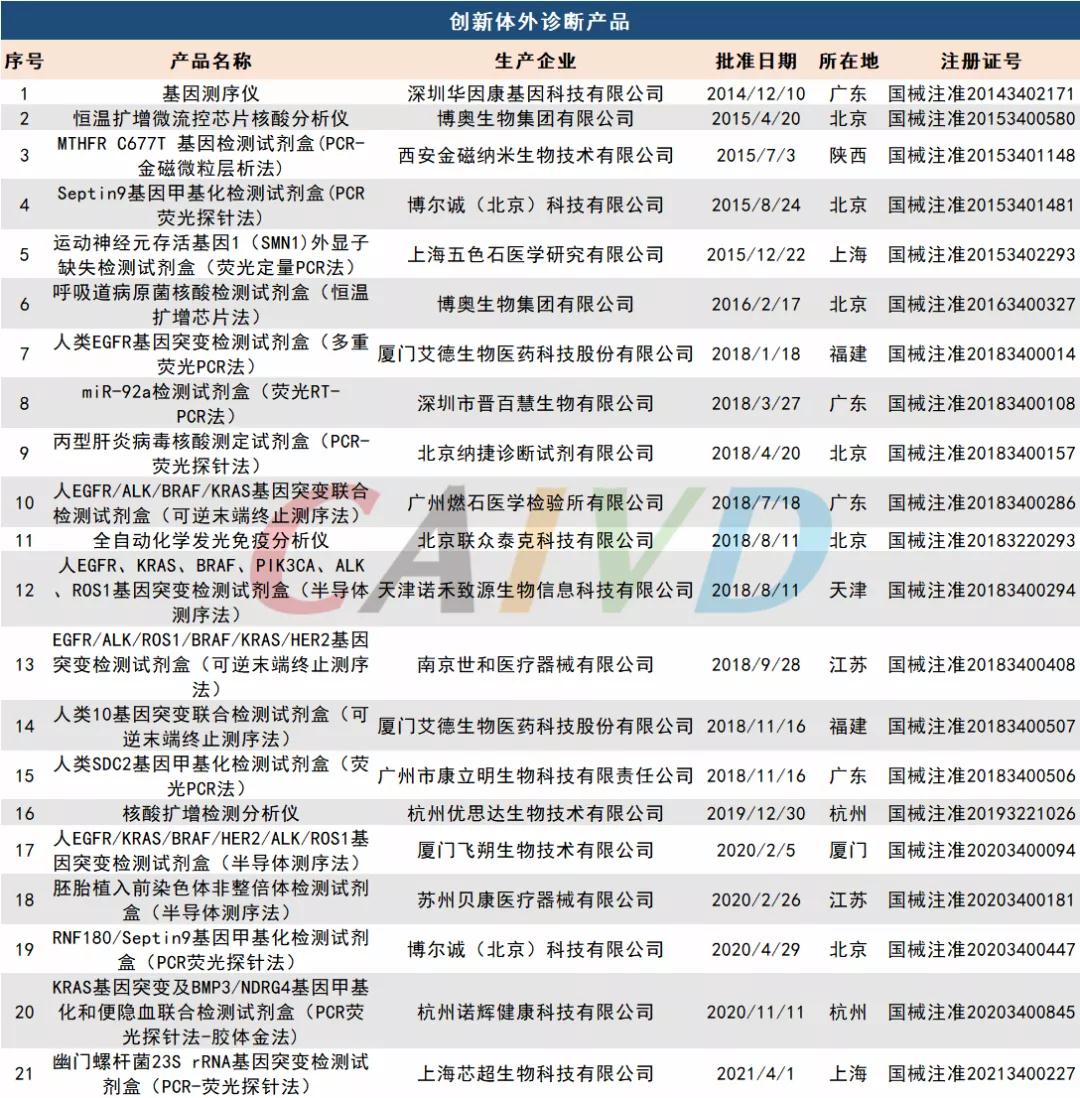
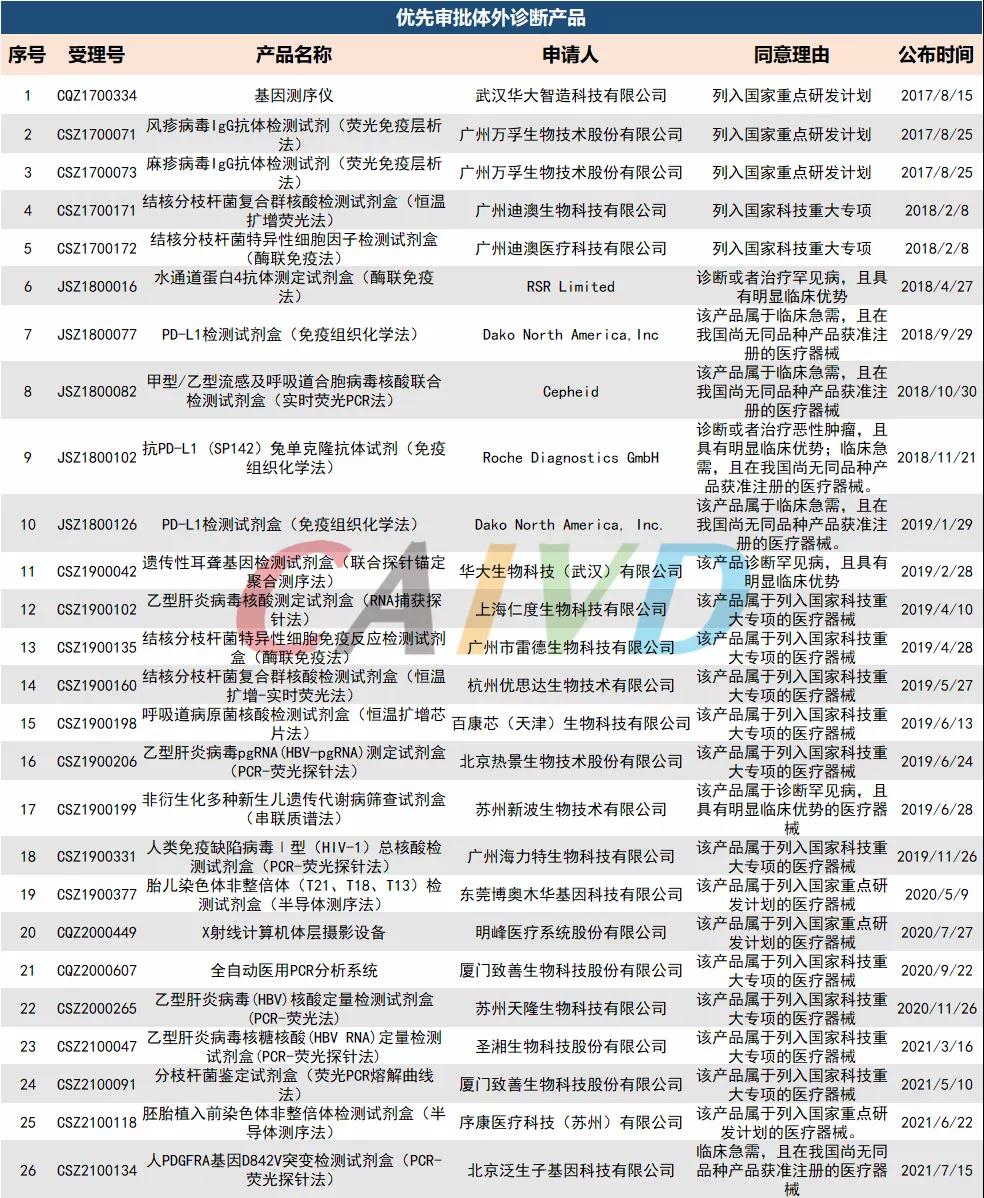
截至目前国内已有21款创新IVD产品上市,26款IVD产品进入优先审批通道,这给中国IVD行业注入些许生机与活力。经过40年来的变革、洗礼和考验,经过新冠的磨砺,中国IVD行业虽然起步晚,但如今已经进入快速发展期,未来可期。不论是大规模“出海”,还是国产替代,都离不开好产品的支撑。相信未来,在政策等有利环境下,优秀IVD产品依旧层出不穷,更加让医生满意,患者放心!
创新体外诊断产品汇总
 1
1
优先审批体外诊断产品汇总
本文转载至其他网站,并不用于商业途径,如有侵权请联系删除。021-51210388
2021深圳国际检验医学及体外诊断试剂展览会(CEIVD 2021)定于2021年8月18-20日在深圳会展中心举办,会主要来自政府机构、全国三甲级医院的检验科、临检中心、独立检验实验室、妇幼保健院、疾病控制预防中心、血站、血液中心和出入境检验检疫局等部门的主任、教授、医生以及专家、学者汇聚展会现场进行交易、合作、交流;随着展会面积扩大、参展企业增多以及观众数量的逐年上升,为了充分展示临床检验医学产品,加强技术交流与合作,推动我国临床检验仪器及体外诊断试剂行业快速发展, 组织单位以“为人类健康作出正确的诊断、为更好的明天而努力”为宗旨,相信本次展会定为你带来无限商机,望各临床检验设备及相关单位积极报名参与! 参展咨询热线:13661622034 金舒妍
上一篇:矮油!!!科华生物居然也卖萌啦!
下一篇:祝贺博科生物成立十四周年